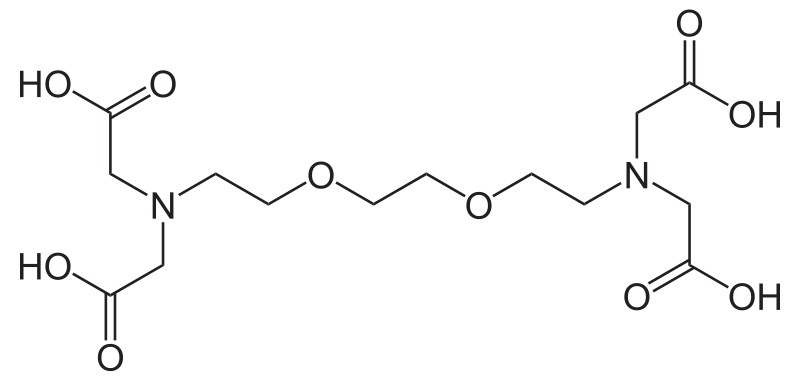
El EDTA (ácido etilendiaminotetraacético) y el EGTA (ácido etilendiaminotriacético) son dos compuestos químicos que se utilizan ampliamente en diversas aplicaciones científicas y médicas. Ambos son quelantes, lo que significa que tienen la capacidad de unirse a iones metálicos, formando complejos que pueden ser eliminados del medio. Sin embargo, existen diferencias fundamentales entre ellos que son importantes para su uso en diferentes contextos. En este artículo, exploraremos estas diferencias, sus estructuras químicas, propiedades, aplicaciones y mucho más.
Estructura química
La estructura química del EDTA es bastante compleja y se basa en un núcleo de etilendiamina con cuatro grupos carboxilo. Esto le permite formar complejos con varios iones metálicos. Cada uno de estos grupos carboxilo puede unirse a un ion metálico, lo que resulta en una alta estabilidad de los complejos formados. El EDTA tiene la fórmula química C10H16N2O8, lo que indica que está compuesto por diez átomos de carbono, dieciséis de hidrógeno, dos de nitrógeno y ocho de oxígeno.
Por otro lado, el EGTA tiene una estructura similar, pero con una diferencia clave en su composición. En lugar de tener cuatro grupos carboxilo, el EGTA tiene solo tres, lo que le confiere propiedades diferentes en cuanto a su capacidad para quelar iones metálicos. La fórmula química del EGTA es C10H14N2O7, lo que significa que, aunque es similar al EDTA, su estructura permite una unión preferencial a ciertos iones metálicos, como el calcio, en comparación con otros metales.
 Diferencia entre Enterococcus faecalis y Faecium
Diferencia entre Enterococcus faecalis y FaeciumPropiedades de quelación
Las propiedades de quelación son fundamentales para entender cómo funcionan el EDTA y el EGTA en diferentes aplicaciones. El EDTA es conocido por su capacidad para quelar una amplia gama de iones metálicos, incluyendo metales como el hierro, el cobre y el zinc. Esto lo convierte en una herramienta valiosa en la eliminación de metales pesados y en el tratamiento de intoxicaciones por metales. Además, el EDTA se utiliza en la industria alimentaria como conservante, ya que ayuda a prevenir la oxidación de los alimentos.
El EGTA, en cambio, tiene una afinidad mucho mayor por el ion calcio en comparación con otros metales. Esto se debe a que su estructura química le permite formar complejos estables con el calcio, lo que lo hace útil en estudios bioquímicos y en la investigación de procesos celulares donde el calcio juega un papel crucial. Por ejemplo, en estudios de señalización celular, el EGTA se utiliza para eliminar el calcio de las soluciones, lo que permite observar el efecto de la ausencia de este ion en diversas reacciones.
 Diferencia entre fundición y forja
Diferencia entre fundición y forjaAplicaciones en biología y medicina
En el ámbito de la biología y la medicina, tanto el EDTA como el EGTA tienen aplicaciones específicas que se derivan de sus propiedades de quelación. El EDTA se utiliza comúnmente en tratamientos médicos para eliminar metales pesados del cuerpo, como en el caso de la intoxicación por plomo. Su capacidad para unirse a estos metales permite que sean excretados por los riñones, ayudando a limpiar el organismo de sustancias nocivas.
El EGTA, por otro lado, es más utilizado en investigaciones relacionadas con el calcio. En experimentos de laboratorio, se emplea para controlar la concentración de calcio en soluciones, lo que es esencial en estudios de bioquímica y fisiología. Por ejemplo, en la investigación sobre la contracción muscular, se puede usar EGTA para reducir la concentración de calcio y observar cómo esto afecta la función muscular. Esto ayuda a los científicos a entender mejor los mecanismos que regulan la actividad celular.
Diferencias en el uso en laboratorios
En el laboratorio, la elección entre EDTA y EGTA puede depender del tipo de experimento que se esté realizando. Por ejemplo, si el objetivo es eliminar metales pesados de una muestra o un organismo, el EDTA es la opción preferida debido a su amplio espectro de quelación. Esto es especialmente relevante en el análisis de muestras biológicas, donde se desea eliminar interferencias metálicas que puedan afectar los resultados de los análisis.
 Diferencia entre migración e invasión celular
Diferencia entre migración e invasión celularPor otro lado, si el enfoque del experimento es estudiar los efectos del calcio en procesos biológicos, el EGTA es la elección ideal. Su afinidad por el calcio permite a los investigadores manipular las condiciones experimentales de manera más efectiva. Por ejemplo, en estudios sobre la neurotransmisión, se puede usar EGTA para eliminar el calcio y observar cómo esto afecta la liberación de neurotransmisores. Esto es fundamental para entender los mecanismos detrás de la comunicación celular.
Consideraciones de seguridad
Al trabajar con compuestos químicos como el EDTA y el EGTA, es importante tener en cuenta las consideraciones de seguridad. Aunque ambos compuestos son generalmente considerados seguros en las concentraciones utilizadas en laboratorios y tratamientos médicos, siempre es recomendable seguir las pautas de seguridad adecuadas. Por ejemplo, se deben utilizar guantes y gafas de protección al manipular estas sustancias, y se debe trabajar en un área bien ventilada para evitar la inhalación de polvo o vapores.
Además, es fundamental manejar adecuadamente los desechos que puedan contener EDTA o EGTA, ya que su eliminación incorrecta puede tener efectos adversos en el medio ambiente. Las regulaciones locales sobre la disposición de productos químicos deben ser seguidas cuidadosamente para evitar la contaminación y garantizar la seguridad pública. Esto es especialmente importante en entornos de investigación, donde la responsabilidad ambiental es una prioridad.
Comparación de costos y disponibilidad
En términos de costos y disponibilidad, tanto el EDTA como el EGTA son relativamente accesibles en el mercado. Sin embargo, el EDTA tiende a ser más comúnmente utilizado y, por lo tanto, a menudo está más disponible en diversas formas, como en polvo o soluciones. Esto puede hacer que el EDTA sea más económico para laboratorios que requieren un quelante general.
El EGTA, aunque también está disponible, puede ser un poco más costoso debido a su uso más específico y su menor demanda en comparación con el EDTA. Sin embargo, para aquellos laboratorios que trabajan en áreas donde la manipulación del calcio es crucial, el costo adicional puede justificarse por los beneficios que ofrece. La elección entre uno u otro puede depender también del presupuesto del laboratorio y de la frecuencia con la que se necesiten estos compuestos para experimentos específicos.
Conclusiones sobre su efectividad
tanto el EDTA como el EGTA son compuestos útiles en diversas aplicaciones científicas y médicas. Sin embargo, su efectividad puede variar dependiendo del contexto en el que se utilicen. El EDTA es más versátil en términos de los metales que puede quelar, lo que lo hace ideal para aplicaciones generales, mientras que el EGTA es más específico para el ion calcio, lo que lo convierte en una herramienta valiosa en estudios bioquímicos. La elección entre ambos dependerá de las necesidades específicas del experimento y de los objetivos del investigador.
Además, es esencial considerar las implicaciones de seguridad y el impacto ambiental al utilizar estos compuestos. Con un manejo adecuado y una comprensión clara de sus propiedades, tanto el EDTA como el EGTA pueden ser utilizados de manera efectiva en la investigación científica y en la medicina, contribuyendo al avance del conocimiento en diversas áreas.