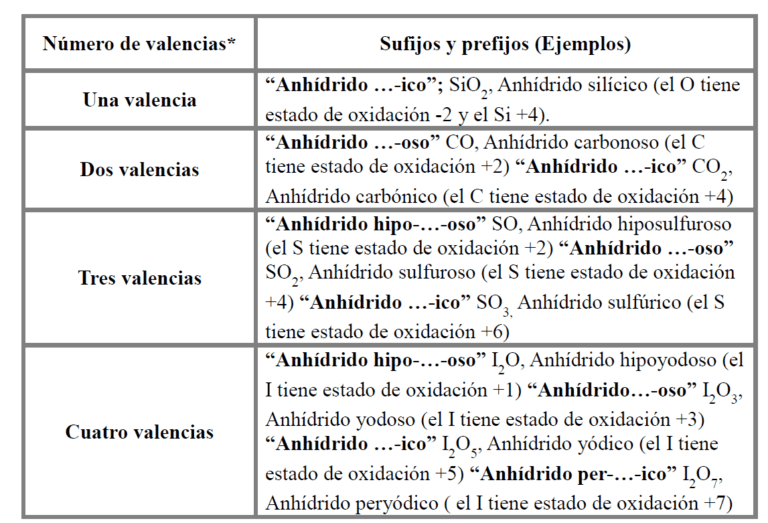
La química es una ciencia fascinante que nos permite entender la composición, estructura y propiedades de la materia. Uno de los conceptos importantes en química es la diferencia entre el anhidro y el dihidrato. Estos términos se refieren a la presencia o ausencia de agua en compuestos químicos. A menudo, se utilizan en el contexto de sales y otros compuestos que pueden existir en diferentes formas, dependiendo de si contienen agua o no. En este artículo, exploraremos en profundidad estas diferencias, sus implicaciones y ejemplos de cada uno.
Definición de Anhidro
El término anhidro proviene del griego «an» que significa «sin» y «hydro» que significa «agua». Por lo tanto, un compuesto anhidro es aquel que no contiene moléculas de agua en su estructura. En la química, esto es especialmente relevante para las sales, que pueden existir en forma anhidra o hidratada. La forma anhidra de un compuesto puede tener propiedades físicas y químicas diferentes en comparación con su forma hidratada. Por ejemplo, el sulfato de cobre anhidro (CuSO4) es un sólido blanco, mientras que el sulfato de cobre pentahidratado (CuSO4·5H2O) es un cristal azul.
Los compuestos anhidros se obtienen generalmente al calentar la forma hidratada, eliminando así el agua. Este proceso se conoce como deshidratación. Es importante señalar que no todos los compuestos pueden ser deshidratados fácilmente; algunos pueden descomponerse antes de perder agua. Además, la falta de agua en un compuesto anhidro puede influir en su solubilidad y reactividad química. Por lo tanto, entender las propiedades de los compuestos anhidros es crucial en muchos campos de la ciencia, incluyendo la química industrial y la farmacología.
 Diferencia entre el método Dumas y el método Kjeldahl
Diferencia entre el método Dumas y el método KjeldahlDefinición de Dihidrato
Por otro lado, el término dihidrato se refiere a compuestos que contienen dos moléculas de agua por cada unidad de fórmula del compuesto. Al igual que el término anhidro, el prefijo «di» indica la cantidad de agua presente. Por ejemplo, el sulfato de cobre dihidratado (CuSO4·2H2O) contiene dos moléculas de agua por cada molécula de sulfato de cobre. Este tipo de compuestos suele ser más estable en condiciones ambientales normales y presenta propiedades diferentes en comparación con su forma anhidra.
Los dihidratos son importantes en diversas aplicaciones industriales y científicas. Por ejemplo, en la industria farmacéutica, muchos medicamentos se presentan en forma de dihidratos para garantizar su estabilidad y solubilidad. La presencia de agua en la estructura del dihidratado puede influir en la forma en que el compuesto se disuelve en el cuerpo humano, afectando su eficacia. Además, los dihidratos pueden ser utilizados como agentes deshidratantes en ciertas reacciones químicas, donde la eliminación controlada de agua es necesaria.
 Diferencia entre epitelización y granulación
Diferencia entre epitelización y granulaciónDiferencias en Propiedades Físicas
Las diferencias en la presencia de agua entre los compuestos anhidros y dihidratados afectan sus propiedades físicas. Por ejemplo, la solubilidad en agua de un compuesto anhidro puede ser diferente a la de su forma hidratada. En muchos casos, los dihidratos son más solubles en agua que sus contrapartes anhidras. Esto se debe a que las moléculas de agua en el dihidratado pueden interactuar con el soluto, facilitando su disolución. Por el contrario, los compuestos anhidros pueden ser menos solubles, lo que puede limitar su uso en ciertas aplicaciones.
Además, la estructura cristalina de los compuestos también puede variar. Los compuestos anhidros tienden a formar cristales más densos y compactos, mientras que los dihidratos pueden tener estructuras más sueltas debido a la presencia de agua. Esta diferencia en la estructura cristalina no solo afecta la apariencia visual de los compuestos, sino también su manejo y almacenamiento. Por ejemplo, los compuestos anhidros pueden ser más propensos a absorber humedad del aire, lo que puede ser un problema en su almacenamiento y uso.
Ejemplos Comunes
Para ilustrar mejor la diferencia entre anhidro y dihidrato, veamos algunos ejemplos comunes. Uno de los ejemplos más conocidos es el sulfato de cobre. Como mencionamos anteriormente, el sulfato de cobre anhidro (CuSO4) es un sólido blanco, mientras que el sulfato de cobre pentahidratado (CuSO4·5H2O) es un cristal azul vibrante. Esta diferencia en color es un indicativo visual de la presencia de agua en la estructura del compuesto. El sulfato de cobre dihidratado es utilizado comúnmente en laboratorios y en la agricultura como fungicida.
 Diferencia entre la hemaglutinina y la neuraminidasa
Diferencia entre la hemaglutinina y la neuraminidasaOtro ejemplo es el cloruro de sodio, que puede existir en forma anhidra o como dihidrato. El cloruro de sodio anhidro (NaCl) es la sal común que usamos en la cocina, mientras que el cloruro de sodio dihidratado (NaCl·2H2O) puede encontrarse en algunos productos farmacéuticos. La forma dihidratada puede ser preferible en ciertas aplicaciones debido a su mayor solubilidad y estabilidad. En la industria alimentaria, la forma anhidra es más común, ya que se utiliza para la conservación de alimentos.
Aplicaciones Industriales
Las diferencias entre compuestos anhidros y dihidratados tienen implicaciones significativas en diversas aplicaciones industriales. Por ejemplo, en la industria de la construcción, los materiales como el yeso pueden presentarse en forma anhidra o hidratada. El yeso anhidro se utiliza a menudo como un material de construcción ligero, mientras que el yeso dihidratado se utiliza en la fabricación de paneles de yeso y otros productos. La elección entre la forma anhidra o dihidratada depende de las propiedades requeridas en el producto final.
En la industria farmacéutica, como mencionamos anteriormente, la forma en que un medicamento se presenta puede afectar su eficacia. Los medicamentos en forma de dihidrato pueden tener una mayor solubilidad, lo que permite una absorción más rápida en el cuerpo. Por otro lado, los compuestos anhidros pueden ser preferidos en ciertas formulaciones donde la estabilidad a largo plazo es crítica. Esta consideración es fundamental en el desarrollo de fármacos y productos químicos, ya que influye en la forma en que se fabrican y almacenan.
Impacto en la Reacción Química
La presencia o ausencia de agua en un compuesto también puede tener un gran impacto en su comportamiento durante las reacciones químicas. Los compuestos anhidros a menudo son más reactivos que sus formas hidratadas. Esto se debe a que el agua puede actuar como un solvente, moderando la reactividad de un compuesto. Por ejemplo, en reacciones de deshidratación, la eliminación de agua puede llevar a la formación de nuevos enlaces químicos y estructuras. Por lo tanto, los químicos deben tener en cuenta la forma en que un compuesto se presenta al planificar experimentos o procesos industriales.
Además, la reacción de hidratación, donde un compuesto anhidro absorbe agua para convertirse en su forma hidratada, es un proceso importante en muchos contextos. Este proceso no solo afecta la estabilidad de los compuestos, sino que también puede influir en la velocidad de reacción. En algunos casos, la adición de agua puede ser necesaria para activar un catalizador, lo que a su vez puede acelerar la reacción. Por lo tanto, entender la dinámica entre anhidro y dihidrato es crucial para optimizar procesos químicos.
Estabilidad y Almacenamiento
La estabilidad de los compuestos anhidros y dihidratados también es un factor importante a considerar. Los compuestos anhidros tienden a ser más higroscópicos, lo que significa que pueden absorber humedad del aire. Esto puede hacer que se degraden o cambien de forma, lo que puede ser problemático en términos de almacenamiento. Por lo tanto, es esencial que los compuestos anhidros se almacenen en condiciones controladas para evitar la absorción de humedad. Esto es especialmente relevante en la industria química, donde la pureza y la estabilidad del producto son críticas.
Por otro lado, los compuestos dihidratados suelen ser más estables en condiciones ambientales normales. Su capacidad para retener agua les permite mantener su estructura y propiedades. Sin embargo, también deben almacenarse adecuadamente para evitar la pérdida de agua, que podría convertirlos en su forma anhidra. Por lo tanto, el almacenamiento adecuado y la manipulación de ambos tipos de compuestos son esenciales para garantizar su eficacia y utilidad en diversas aplicaciones.
Conclusiones sobre Anhidro y Dihidrato
La diferencia entre compuestos anhidros y dihidratados es fundamental en el estudio de la química y tiene aplicaciones en una variedad de campos. Comprender estas diferencias no solo ayuda a los científicos a manipular estos compuestos de manera efectiva, sino que también permite un mejor desarrollo de productos en industrias como la farmacéutica, la construcción y la alimentación. La química es una ciencia que nos enseña sobre la naturaleza de los materiales y sus interacciones, y el estudio de anhidros y dihidratos es solo una pequeña parte de este vasto campo.
El conocimiento sobre estas diferencias puede ser muy útil en la vida cotidiana, ya que muchos de los productos que utilizamos a diario están relacionados con compuestos químicos. Desde la sal de mesa hasta los medicamentos, comprender cómo funcionan estos compuestos puede mejorar nuestra comprensión de la ciencia que nos rodea. Además, la investigación continua en este campo podría llevar a nuevos descubrimientos y aplicaciones, lo que demuestra la importancia de seguir explorando y aprendiendo sobre la química.