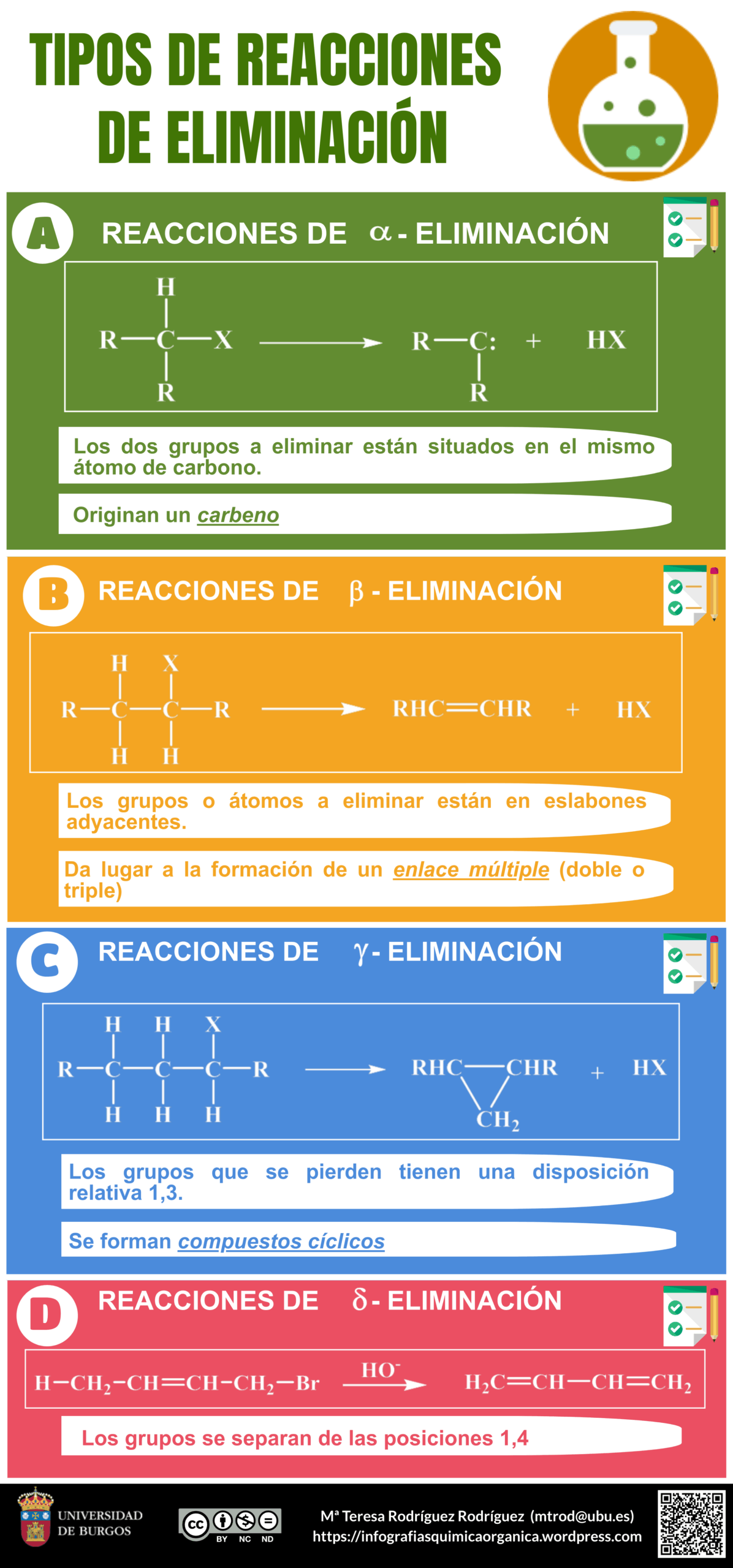
En el estudio de la química orgánica, las reacciones de eliminación son procesos fundamentales que permiten la transformación de compuestos a través de la eliminación de átomos o grupos de átomos. Existen diferentes tipos de reacciones de eliminación, entre las cuales se destacan las reacciones de eliminación alfa y beta. Estas dos reacciones tienen características específicas que las diferencian y son importantes para entender los mecanismos de reacciones en química orgánica. En este artículo, exploraremos las diferencias entre estas dos reacciones, sus mecanismos, ejemplos y aplicaciones en la química.
Definición de Reacciones de Eliminación
Las reacciones de eliminación son un tipo de reacción en la que se eliminan átomos o grupos de átomos de una molécula, resultando en la formación de un doble enlace o un triple enlace. Estas reacciones son fundamentales en la síntesis orgánica, ya que permiten la formación de compuestos insaturados a partir de compuestos saturados. En la eliminación, el grupo que se elimina puede ser un hidrógeno, un halógeno o un grupo funcional, y su eliminación generalmente resulta en la formación de un producto más estable.
 Diferencia entre Vibrio Cholerae y Vibrio Parahaemolyticus
Diferencia entre Vibrio Cholerae y Vibrio ParahaemolyticusLas reacciones de eliminación se clasifican principalmente en dos categorías: eliminación alfa y eliminación beta. La diferencia principal entre ellas radica en la posición de los átomos que se eliminan en relación con el grupo funcional de la molécula. Entender estas diferencias es crucial para los químicos que buscan manipular estructuras moleculares para obtener compuestos deseados.
Reacción de Eliminación Alfa
La reacción de eliminación alfa se refiere a un proceso en el que se elimina un átomo de hidrógeno y un grupo saliente de la posición alfa de una molécula. La posición alfa es el carbono que está directamente unido al grupo funcional, como un grupo carbonilo. En este tipo de reacción, la eliminación ocurre en el carbono adyacente al grupo funcional, lo que resulta en la formación de un doble enlace entre el carbono alfa y el carbono beta, que es el siguiente carbono en la cadena.
Este tipo de eliminación es común en reacciones de deshidratación y deshidrogenación. Por ejemplo, en la deshidratación de alcoholes, un grupo hidroxilo (-OH) y un hidrógeno se eliminan del carbono alfa, resultando en la formación de un alqueno. La reacción de eliminación alfa es importante en la síntesis de compuestos insaturados, que tienen propiedades químicas y físicas diferentes a sus precursores saturados.
 Diferencia entre evolución paralela y convergente
Diferencia entre evolución paralela y convergenteMecanismo de la Eliminación Alfa
El mecanismo de la reacción de eliminación alfa puede ser complejo y variar dependiendo de las condiciones de la reacción y la naturaleza de los reactivos. Sin embargo, en términos generales, se puede describir en varios pasos. Primero, el grupo saliente se activa, lo que significa que se hace más propenso a ser eliminado. Esto puede implicar la protonación del grupo hidroxilo o la formación de un intermediario carbanión.
- Formación de un intermediario: En algunos casos, se forma un intermediario que puede ser un carbanión o un carbocatión.
- Eliminación del grupo saliente: Una vez que el intermediario está formado, se elimina el grupo saliente, liberando un átomo de hidrógeno.
- Formación del producto: Finalmente, se forma el producto final, que es un alqueno o una estructura insaturada.
Este mecanismo se puede observar en diversas reacciones, como la eliminación de agua de alcoholes o la eliminación de halógenos de halogenuros de alquilo. La estabilidad del producto final y la naturaleza del grupo saliente son factores cruciales que afectan la dirección y la velocidad de la reacción.
Reacción de Eliminación Beta
Por otro lado, la reacción de eliminación beta implica la eliminación de átomos de hidrógeno y un grupo saliente que están en la posición beta de la molécula. La posición beta es el carbono que se encuentra a dos enlaces del grupo funcional. En este tipo de reacción, el producto resultante también es un alqueno, pero la eliminación ocurre en una posición diferente en la cadena de carbonos, lo que puede influir en la estabilidad del producto final.
 Diferencia entre NMN y NAD+
Diferencia entre NMN y NAD+Las reacciones de eliminación beta son comunes en la deshidratación de alcoholes y en la eliminación de halógenos de halogenuros de alquilo. A menudo, este tipo de reacción es favorecida en condiciones de alta temperatura o en presencia de ácidos fuertes, que pueden promover la eliminación de grupos salientes de la posición beta, en lugar de la posición alfa.
Mecanismo de la Eliminación Beta
El mecanismo de la reacción de eliminación beta también puede ser descrito en varios pasos. Similar a la eliminación alfa, comienza con la activación del grupo saliente. Sin embargo, en este caso, el enfoque está en la eliminación de un hidrógeno del carbono beta, lo que resulta en la formación de un doble enlace entre el carbono alfa y el carbono beta.
- Activación del grupo saliente: El grupo saliente se protona o se activa de alguna manera, lo que lo hace más propenso a ser eliminado.
- Eliminación de hidrógeno: Se elimina un hidrógeno del carbono beta, formando un doble enlace entre el carbono alfa y beta.
- Formación del producto: El producto final es un alqueno, que puede ser más estable dependiendo de la substitución en el doble enlace.
En este tipo de reacción, la estabilidad del producto final es un factor clave. Los alquenos más sustituidos son generalmente más estables debido a la menor tensión en el doble enlace. Esto significa que, en condiciones favorables, la reacción de eliminación beta puede dar lugar a productos más estables que la eliminación alfa.
Diferencias Clave entre Eliminación Alfa y Beta
Las diferencias entre la reacción de eliminación alfa y beta son fundamentales para los químicos que buscan entender cómo manipular compuestos orgánicos. Una de las diferencias más evidentes es la posición de los átomos que se eliminan en relación con el grupo funcional. En la eliminación alfa, los átomos eliminados están en la posición alfa, mientras que en la eliminación beta, se encuentran en la posición beta.
Además, las condiciones de reacción y la estabilidad del producto final son otros factores que distinguen a estas dos reacciones. Por lo general, las reacciones de eliminación beta tienden a ser más favorecidas en condiciones de alta temperatura y en presencia de ácidos fuertes, mientras que las reacciones de eliminación alfa pueden ocurrir más fácilmente en condiciones menos extremas. La naturaleza del grupo saliente también juega un papel importante, ya que grupos salientes más estables favorecen la eliminación en ambas reacciones.
Comparación de Productos Finales
Los productos finales de las reacciones de eliminación alfa y beta pueden diferir significativamente en términos de estructura y propiedades. En la eliminación alfa, el producto resultante es un alqueno que puede tener diferentes isómeros dependiendo de la ubicación del doble enlace. Por otro lado, la eliminación beta generalmente resulta en un alqueno que es más sustituido y, por lo tanto, más estable.
- El producto de eliminación alfa puede ser menos estable debido a la menor sustitución en el doble enlace.
- Los productos de eliminación beta tienden a ser más estables y pueden ser más favorables en condiciones de reacción específicas.
- La estructura y la reactividad de los productos finales pueden influir en su uso en síntesis química y aplicaciones industriales.
Esta diferencia en la estabilidad de los productos finales es crucial para la selección de la ruta de reacción en la síntesis orgánica, ya que los químicos a menudo buscan productos más estables y deseables para sus aplicaciones específicas.
Ejemplos de Reacciones de Eliminación Alfa y Beta
Para ilustrar mejor las diferencias entre las reacciones de eliminación alfa y beta, es útil examinar algunos ejemplos concretos. Un ejemplo clásico de eliminación alfa es la deshidratación de alcoholes. Cuando un alcohol se calienta en presencia de un ácido, puede perder una molécula de agua, resultando en la formación de un alqueno. En este caso, el grupo -OH se elimina junto con un hidrógeno del carbono alfa, lo que lleva a la formación de un doble enlace.
En contraste, un ejemplo de eliminación beta puede observarse en la deshidrohalogenación de halogenuros de alquilo. Cuando un halogenuro de alquilo se trata con una base fuerte, puede eliminar un halógeno y un hidrógeno del carbono beta, formando un alqueno. Este proceso tiende a favorecer la formación de alquenos más sustituidos, lo que demuestra la estabilidad que se puede obtener a través de la eliminación beta.
Aplicaciones Prácticas
Las reacciones de eliminación alfa y beta tienen numerosas aplicaciones en la síntesis orgánica y en la industria química. Por ejemplo, la eliminación alfa es fundamental en la producción de alquenos a partir de alcoholes, que son intermediarios importantes en la síntesis de una amplia variedad de productos químicos, incluidos fármacos, plásticos y productos petroquímicos.
- La eliminación beta, por su parte, es esencial en la producción de compuestos más complejos y en la modificación de estructuras existentes.
- Ambas reacciones son utilizadas en la síntesis de compuestos naturales y en la fabricación de productos farmacéuticos.
- Los alquenos producidos a través de estas reacciones son utilizados en la producción de polímeros y otros materiales.
Además, el entendimiento de estas reacciones permite a los químicos desarrollar nuevos métodos de síntesis, optimizar procesos existentes y descubrir nuevas rutas para la creación de compuestos útiles. Por lo tanto, la diferencia entre eliminación alfa y beta no solo es académica, sino que tiene implicaciones prácticas en el mundo real.
Conclusión
En resumen, las reacciones de eliminación alfa y beta son procesos químicos fundamentales que permiten la transformación de compuestos orgánicos. A través de la eliminación de átomos o grupos de átomos, estas reacciones conducen a la formación de productos insaturados, que son esenciales en la química orgánica. Comprender las diferencias entre estas dos reacciones, así como sus mecanismos y aplicaciones, es crucial para los químicos y científicos que trabajan en el campo de la química.