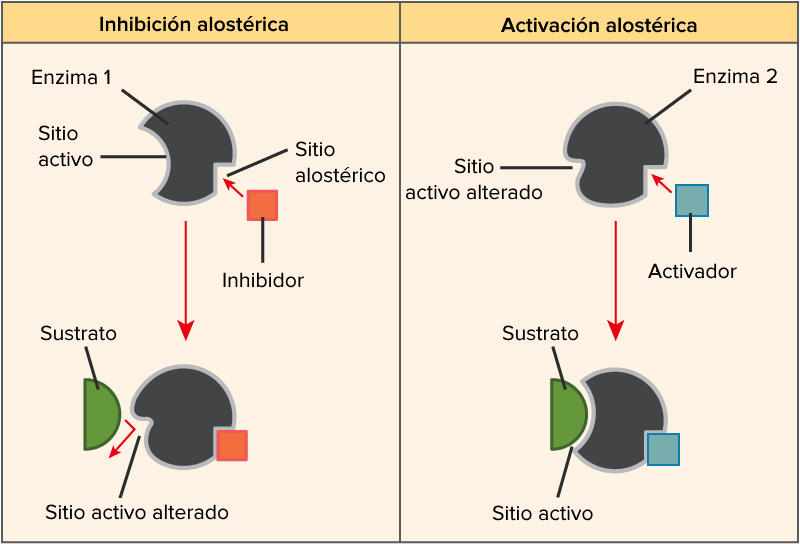
Las enzimas son proteínas que actúan como catalizadores biológicos, acelerando reacciones químicas en los organismos. Para entender cómo funcionan, es crucial conocer la diferencia entre un activador enzimático y un inhibidor enzimático. Estos dos tipos de compuestos tienen efectos opuestos sobre la actividad enzimática, lo que influye en muchos procesos biológicos. Un activador enzimático aumenta la actividad de una enzima, mientras que un inhibidor enzimático la disminuye. Esta interacción es fundamental en la regulación del metabolismo y en la respuesta de las células a diferentes estímulos.
¿Qué es un activador enzimático?
Un activador enzimático es una molécula que aumenta la actividad de una enzima al unirse a ella y facilitar su función. Estos compuestos pueden ser iones metálicos, cofactores o moléculas orgánicas que, al unirse a la enzima, cambian su estructura o su conformación. Esta modificación permite que la enzima se una más eficazmente a su sustrato, lo que resulta en una reacción química más rápida. Por ejemplo, el ion de calcio es un activador que ayuda a muchas enzimas en procesos como la contracción muscular.
 ¿Cómo activan las células T auxiliares a las células B?
¿Cómo activan las células T auxiliares a las células B?Los activadores pueden ser esenciales para el funcionamiento de ciertas enzimas. Sin ellos, la enzima puede permanecer inactiva o menos eficiente. Existen diferentes tipos de activadores, incluyendo los cofactores, que son moléculas no proteicas necesarias para la actividad enzimática. Estos cofactores pueden ser iones metálicos, como el zinc o el magnesio, que se unen a la enzima y permiten que esta realice su función correctamente.
Ejemplos de activadores enzimáticos
- Calcio (Ca²+): Un ion que actúa como activador en diversas enzimas.
- Magnesio (Mg²+): Fundamental en la activación de enzimas que participan en el metabolismo energético.
- ATP (adenosín trifosfato): Actúa como activador en muchas reacciones biológicas al transferir grupos fosfato.
El papel de los activadores enzimáticos es crucial en muchos procesos metabólicos. Por ejemplo, en la gluconeogénesis, la formación de glucosa a partir de compuestos no glucídicos, varios activadores son necesarios para que las enzimas involucradas funcionen adecuadamente. Sin estos activadores, las reacciones no ocurrirían con la suficiente rapidez para satisfacer las necesidades del organismo.
¿Qué es un inhibidor enzimático?
Un inhibidor enzimático es una molécula que disminuye la actividad de una enzima. Los inhibidores pueden actuar de diversas maneras, interfiriendo con la capacidad de la enzima para unirse a su sustrato o alterando su estructura para que no funcione correctamente. Existen dos tipos principales de inhibidores: los inhibidores competitivos y los inhibidores no competitivos. Los inhibidores competitivos se unen al sitio activo de la enzima, bloqueando el acceso del sustrato. Por otro lado, los inhibidores no competitivos se unen a la enzima en un sitio diferente, alterando su actividad sin bloquear el sitio activo.
 ¿Cómo afecta el ciclo del carbono a la hidrosfera?
¿Cómo afecta el ciclo del carbono a la hidrosfera?Los inhibidores enzimáticos son fundamentales en la regulación de las reacciones bioquímicas. Permiten que las células controlen la velocidad de las reacciones y respondan a cambios en su entorno. Por ejemplo, en la fármaco-terapia, muchos medicamentos actúan como inhibidores enzimáticos para tratar diversas enfermedades. Al inhibir enzimas específicas, se puede reducir la producción de sustancias dañinas o alterar rutas metabólicas que contribuyen a enfermedades.
Ejemplos de inhibidores enzimáticos
- Ácido acetilsalicílico: Inhibe la enzima ciclooxigenasa, reduciendo la inflamación.
- Penicilina: Inhibe la síntesis de la pared celular en bacterias.
- Estatinas: Inhiben la enzima HMG-CoA reductasa, reduciendo los niveles de colesterol.
La inhibición enzimática puede ser reversible o irreversible. En la inhibición reversible, la unión del inhibidor a la enzima es temporal, lo que permite que la enzima recupere su actividad una vez que el inhibidor se disocia. En cambio, en la inhibición irreversible, el inhibidor se une de forma covalente a la enzima, bloqueando permanentemente su actividad. Este tipo de inhibición es común en algunos fármacos que buscan eliminar la actividad de enzimas específicas en tratamientos médicos.
Interacción entre activadores e inhibidores enzimáticos
La interacción entre activadores e inhibidores enzimáticos es un aspecto esencial en la regulación de las vías metabólicas. La actividad de una enzima puede ser modulada por la presencia de ambos tipos de compuestos. Por ejemplo, una enzima puede ser activada por un activador enzimático en condiciones normales, pero al mismo tiempo puede ser inhibida por un inhibidor enzimático en situaciones de estrés o enfermedad. Esta dualidad permite que las células respondan de manera flexible a las necesidades cambiantes del organismo.
 ¿Cómo afecta la adhesión a los organismos vivos?
¿Cómo afecta la adhesión a los organismos vivos?En muchos casos, la regulación de la actividad enzimática es un proceso complejo que implica múltiples pasos y la acción coordinada de diferentes moléculas. Por ejemplo, en la glucólisis, la ruta metabólica que convierte la glucosa en energía, varias enzimas están sujetas a la regulación por activadores e inhibidores. La concentración de sustratos, productos y otros metabolitos puede influir en la actividad de estas enzimas, asegurando que la producción de energía se ajuste a la demanda celular.
Mecanismos de regulación
- Modificación covalente: Algunas enzimas pueden ser activadas o inhibidas por la adición o eliminación de grupos químicos.
- Feedback negativo: El producto final de una vía metabólica puede inhibir enzimas anteriores en la ruta.
- Cooperatividad: La unión de un sustrato a una subunidad de la enzima puede facilitar la unión de sustratos a otras subunidades.
La regulación de la actividad enzimática es vital para mantener la homeostasis en los organismos. Por ejemplo, en el metabolismo de los carbohidratos, la insulina y el glucagón son hormonas que actúan como reguladores, afectando la actividad de las enzimas involucradas en la síntesis y degradación de glucógeno. Esto asegura que los niveles de glucosa en sangre se mantengan dentro de un rango óptimo para el funcionamiento del organismo.
Aplicaciones en la medicina y biotecnología
La comprensión de la diferencia entre activadores e inhibidores enzimáticos tiene importantes aplicaciones en la medicina y la biotecnología. En el campo médico, el diseño de fármacos que actúan como inhibidores enzimáticos ha revolucionado el tratamiento de diversas enfermedades. Por ejemplo, las estatinas son ampliamente utilizadas para reducir el colesterol y prevenir enfermedades cardiovasculares al inhibir la enzima HMG-CoA reductasa.
En biotecnología, los activadores enzimáticos son utilizados para optimizar procesos industriales. Por ejemplo, en la producción de biocombustibles, se emplean enzimas que requieren activadores para mejorar la conversión de biomasa en etanol. Al comprender cómo los activadores y los inhibidores afectan la actividad enzimática, los científicos pueden diseñar procesos más eficientes y rentables.
Investigación y desarrollo
- Descubrimiento de nuevos fármacos: La identificación de inhibidores específicos puede conducir al desarrollo de tratamientos más eficaces.
- Mejora de cultivos: El uso de activadores enzimáticos puede aumentar la resistencia de las plantas a enfermedades.
- Producción de alimentos: Los activadores pueden mejorar la eficiencia de las enzimas utilizadas en la fermentación.
La investigación en el campo de los activadores e inhibidores enzimáticos continúa siendo un área activa. Nuevas tecnologías y métodos de análisis permiten a los científicos explorar cómo estas moléculas interactúan con las enzimas y cómo se pueden manipular para mejorar procesos biológicos. Esto no solo tiene implicaciones en la medicina, sino también en la agricultura y la producción de alimentos, donde la optimización de las enzimas puede llevar a mejores rendimientos y productos de mayor calidad.
Conclusiones sobre activadores e inhibidores enzimáticos
La diferencia entre un activador enzimático y un inhibidor enzimático es fundamental para entender la regulación de las reacciones bioquímicas en los organismos. Los activadores aumentan la actividad enzimática, mientras que los inhibidores la disminuyen. Esta interacción es esencial para el mantenimiento de la homeostasis y la respuesta a las condiciones cambiantes del entorno. La aplicación de este conocimiento en la medicina y la biotecnología ha llevado a avances significativos en el tratamiento de enfermedades y en la optimización de procesos industriales.
El estudio de los activadores e inhibidores enzimáticos no solo es relevante para la biología, sino que también tiene implicaciones prácticas en diversos campos. Desde el desarrollo de nuevos fármacos hasta la mejora de cultivos agrícolas, la comprensión de cómo estos compuestos afectan la actividad enzimática es crucial para avanzar en la ciencia y la tecnología. A medida que la investigación continúa, es probable que surjan nuevas aplicaciones y descubrimientos que seguirán ampliando nuestro conocimiento sobre el papel de los activadores e inhibidores enzimáticos en la vida.